听觉不仅与人们日常生活紧密相关,也是科学领域的重要研究问题之一。亚里士多德定义的五种感官中,介导嗅觉、味觉、视觉、触觉的受体基因早已被相继确定,两位美国科学家也曾因发现气味受体和嗅觉系统的组织方式而获得了2004年诺贝尔生理学或医学奖。但是,人类对声音感知的核心——负责听觉转导的离子通道是由哪个基因编码的,一直是个谜。
针对这一问题,复旦大学生命科学学院教授闫致强团队与生命科学学院教授服部素之团队、东京大学教授濡木理团队合作,最终确认了TMC1/2为位于耳蜗毛细胞中真正的听觉转导离子通道,解决了已困扰听觉领域近40年的问题。11月21日,相关研究成果以《TMC1和TMC2是成孔的机械力敏感离子通道》(“TMC1 and TMC2 proteins 1 are pore-forming subunits of 2 mechanosensitive ion channels”)为题在线发表于《神经元》(Neuron)杂志。

闫致强教授
另辟蹊径,探秘听觉转导离子通道
科学家探索已久的耳蜗毛细胞中的听觉转导离子通道究竟是何方神圣?团队用研究结果给出了答案——TMC1/2。
闫致强介绍,正如汽车失灵有缺少燃料、方向盘失灵、轮胎爆胎等多种可能原因,在听觉转导通道也有众多的候选基因,都有可能影响听觉转导,这其中就包括TMC1和TMC2基因。TMC1和TMC2最早在耳聋患者中被发现,是毛细胞机械转导电流所必需的蛋白,位于发生机械转导的静纤毛(stereocilia)尖端,且均在毛细胞中表达。早前的研究已经通过遗传学方法阐释了编码跨膜通道样蛋白的TMC1与TMC2基因对小鼠听力的重要性。
“通过之前的研究,我们知道了在小鼠中,TMC1突变会改变其机械敏感电流的特性。但是TMC1和TMC2蛋白是否是离子通道以及TMC1和TMC2是否为机械力门控却一直不清楚。”闫致强解释道:“离子通道是各种无机离子跨膜被动运输的通路,这个被动运输是顺离子浓度梯度、从高向低流的;而门控就是像开关门一样,有一个把关的过程。什么时候打开门?打开门让什么物质进入?这是门控的两个特性。”
团队在研究过程中发现,TMC蛋白在培养的细胞中表达时,难以被运输到细胞膜上,导致其电生理特征难以被正常记录。为了克服这一技术难题,团队另辟蹊径,将纯化所得的TMC1和TMC2蛋白质进行脂质体重组,体外探究TMC蛋白质是否确实作为离子通道发挥功能。
“简单理解,脂质体重组就是我们运用人工的方法制作了一个‘细胞’,它拥有和细胞同样的双层膜结构,然而又不同于真正的细胞,因此就称其为脂质体重组。”闫致强说。
为进行体外重建,团队使用正交筛选,通过基于荧光检测体积排阻色谱的热稳定性检验(fluorescence-detection size-exclusion chromatography-based thermostability assay, FSEC-TS)筛选了来自21种不同物种的TMC蛋白。其中,来自绿海龟(Chelonia mydas)的TMC1(CmTMC1)与来自虎皮鹦鹉(Melopsittacus undulates)的TMC2(MuTMC2)能够在昆虫细胞中高纯度表达。
“基因表达是指将来自基因的遗传信息合成功能性基因产物的过程,主要包括转录和翻译等环节。”闫致强解释道,这就好比种麦子,在不同的地里种麦子,有的产量高、有的产量低,有的甚至都长不出来。“基因表达是类似的道理,也分高表达、低表达和不表达的情况。做实验时我们希望表达量高、纯度好,就像种麦子时也希望它产量高。”
在随后的脂质体重组实验中,团队发现TMC蛋白的确具有离子通道活性,表现为外加电压能够造成蛋白孔道自发打开,产生电流。通过使用高速压力钳(high-speed pressure clamp, HSPC)对重组CmTMC1和MuTMC2通道施加压力,发现二者均可以直接响应机械力,且响应电流强度与单通道打开概率随所施压力增加而增加。另一方面,研究基于导致小鼠失聪的Tmc1突变体蛋白构建了数个保守氨基酸突变的CmTMC1点突变蛋白。体外脂质体重建与功能性实验表明,这些突变体蛋白或具有离子通道活性缺陷,或具有机械响应缺陷。
虽然团队的研究主要集中于CmTMC1和MuTMC2,但其与小鼠的TMC1和TMC2蛋白具有高度进化的保守性。“也就是说,基本可以认为在CmTMC1和MuTMC2发现的研究结果同样适用于小鼠的TMC1和TMC2蛋白。而在这方面,小鼠与人是非常相似的。这表明在哺乳动物中,TMC1/2很可能也是离子通道,并且同样能够响应机械力。此外,TMC1/2还与人类听力损伤密切相关。”闫致强补充。

闫致强教授与团队学生
揭开谜团,解决听觉领域卡脖子问题
“对听觉的理解最终是理解听觉如何转导,即声音如何转导为电信号,这一直是听觉领域最核心的问题,然而40年来这一问题都未能得到解决,可以说是一个卡脖子的问题。”闫致强说:“只有把这个卡脖子的问题解决了,后续的研究才能顺气儿。”
人类对声音的感知始于内耳中的柯蒂氏器(Corti organ)。柯蒂氏器中含有超过16000个毛细胞,而将声音由机械信号转换为电信号的机械传导通道即被认为定位于毛细胞上呈阶梯状排列的毛细胞发束(hair cell bundle)上。约40年前,COREY和HUDSPETH记录了听觉毛细胞的听觉转导电流,然而经过多年的研究,负责听觉转导的分子却一直未能确定,成为听觉领域研究一个亟待解决的至关重要的问题。
介导嗅觉、味觉、视觉、触觉的受体基因早已被相继确定,听觉领域却还未能明确听觉转导的核心问题。抱着探索未知、揭开谜团的决心,团队于2017年开始了研究工作,创新采用脂质体重组等方法最终明确听觉转导的离子通道,解开五种感觉受体的最后一个谜团。
“研究明确了听觉转导的离子通道,医学方面就能进一步探讨对听觉受损的治疗机制,而治疗案例的累计也能帮助发现新的突变。实验室和临床是相互促进的。”闫致强表示,在进行基础科研的同时,团队也将在新生儿听力遗传缺陷的机理研究,以及其预防、诊断和治疗方向做出努力。
复旦大学生命科学学院教授闫致强构思了课题、设计了实验、领导了该研究,为本研究的共同通讯作者和主要负责人 (lead contact)。复旦大学生命科学学院教授服部素之和东京大学教授濡木理为本文的共同通讯作者。闫致强实验室博士生贾岩岩、服部素之实验室博士后赵一梦以及濡木理实验室的博士Tsukasa Kusakizako为本文共同第一作者,博士生王垚、潘成芳、张玉玮参与了该项课题的研究。研究得到国家基金委、国家科技部、上海市教委东方学者、上海市科委启明星计划等基金项目,复旦大学生命科学学院、遗传工程国家重点实验室、医学神经生物学国家重点实验室等单位的支持。
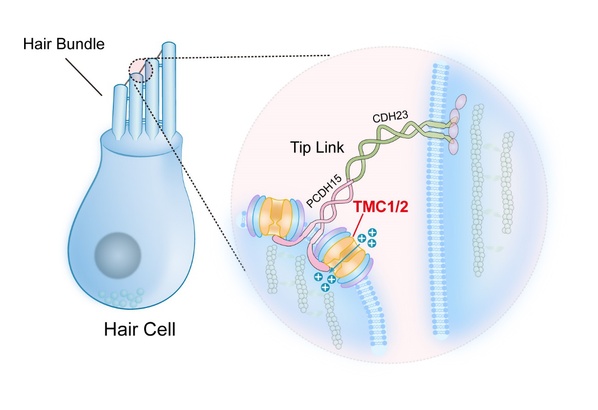
TMC1和TMC2在听觉转导中的作用示意图
论文链接:https://www.cell.com/neuron/fulltext/S0896-6273(19)30890-6





