9月1日,清华大学医学院颜宁教授研究组在《自然》(Nature)期刊发表题为《电压门控钙离子Cav1.1通道3.6埃分辨率结构》(Structure of the voltage-gated calcium channel Cav1.1 at 3.6 angstrom resolution)的研究长文(Research Article),报道了首个真核电压门控钙离子通道的近原子分辨率三维结构,为理解众多具有重要生理和病理功能的电压门控钙离子和钠离子通道的工作机理奠定了基础。
电压门控离子通道是一大类位于细胞膜上、通过感受电信号控制离子跨膜进出细胞的蛋白质。上世纪四五十年代,英国科学家霍奇金和赫胥黎发现了动作电位;之后发现电压门控钠离子通道(Nav通道)引发动作电位,而电压门控钾离子通道(Kv通道)则能使细胞去极化,恢复至静息电位。五十年代,科学家发现在没有钠离子的情况下,依赖钙离子也能产生动作电位,这是由电压门控钙离子通道(Cav通道)介导的生理过程。钙离子本身是细胞内信号传递的第二信使,通过Cav通道,将细胞膜两侧的电信号变化转变为细胞内部的化学信号,引起一系列反应,包括肌肉收缩、腺体分泌、基因转录、细胞凋亡、神经递质的传递等。80年代,首个Cav通道的基因被克隆,序列分析显示,它与Nav通道的序列高度相似。
电压门控离子通道的功能异常或紊乱与一系列疾病相关,比如Nav1.7直接与痛觉相关,其异常激活或失活会导致异常疼痛或者无法感知痛觉。目前已知,Nav1.7突变会导致红斑性肢痛症;Nav1.4或Cav1.1突变会导致低钾性周期瘫痪;Nav1.1或Cav2.1突变导致变异型家族偏瘫型偏头痛;Nav、Cav以及Kv功能异常则可能导致心率紊乱、癫痫等。电压门控离子通道目前是仅次于G蛋白偶联受体(GPCR)的第二大药物靶点。外科手术用到的麻醉剂通过抑制Nav通道起作用;Cav通道则是降压药物的靶点。因此,对于电压门控离子通道的研究,尤其是结构生物学上的研究具有重要的生理学和药理学意义。
与Kv通道近20年的结构生物学进展相比,Nav和Cav通道的结构姗姗来迟,主要是因为与由同源四聚体构成的Kv通道不同,真核生物Nav和Cav通道由一条具有1500-2000个氨基酸的肽链折叠成四个类似但不尽相同的结构域,每个结构域具有六次跨膜螺旋,相邻结构域之间由长度各异的序列连接。这一特点使得蛋白的重组表达和结晶难度相比Kv通道都大大增加。因此,一直以来仅有纳米分辨率的真核生物Nav和Cav通道冷冻电镜影像报道,无法揭示任何结构细节信息。近几年,随着冷冻电镜技术的革新,利用该技术获得近原子分辨率结构已经成为现实。颜宁研究组利用清华大学的冷冻电镜平台,首次揭示了真核生物Cav通道的结构。
Cav1.1是哺乳动物中10个电压门控钙离子通道中的第一个被鉴定的,主要分布在在骨骼肌,它的主要功能是在肌肉细胞接受运动神经元信号产生动作电位时感受膜电势的变化,进而激活与其直接作用的下游肌质网膜上的高通量钙离子通道RyR1,促使钙离子快速大量释放到细胞质中,从而引起肌肉的收缩,该过程称为兴奋-收缩偶联(excitation-contraction coupling,EC coupling),Cav1.1和RyR1是引发这个过程最为关键的两个膜蛋白。 2015年1月,颜宁研究组在《自然》报道了RyR1的3.8埃冷冻电镜结构;同年12月,她们在《科学》上报道了Cav1.1的4.2埃电镜结构。但是由于分别率所限,尽管该结构首次揭示了Cav1.1复合物中各个辅助亚基(包括α2σ亚基、β亚基和γ亚基)与离子通道亚基(α1亚基)的相互作用区域,以及离子通道亚基内部同源结构域的排布,但是大部分区域无法精确到氨基酸侧链,因而不能对蛋白的状态进行深入的分析。在冷冻电镜结构中,4埃的分辨率往往是一个分水岭。要想清晰地分辨出蛋白质氨基酸的侧链,往往需要高于4埃的分辨率(数字越小分辨率越高),而其难度也相应增加。
在刚刚发表的《自然》论文中,颜宁研究组通过多次尝试,成功优化了蛋白的制样方法,从而获得了高质量的冷冻电镜成像。他们从近万张冷冻电镜照片中挑出超过一百万的蛋白单颗粒,利用单颗粒三维重构的方法最终获得了整体3.6埃的近原子分辨率结构,其中中心区域分辨率超过3.5埃(图1)。
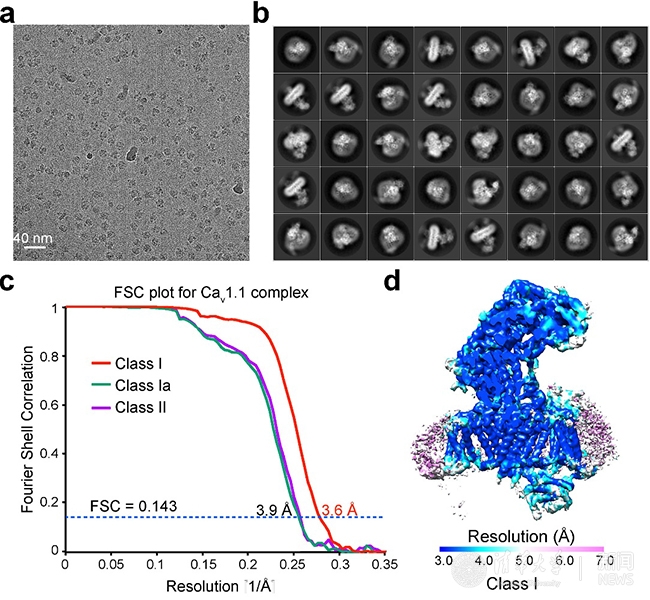
图1:Cav1.1冷冻电镜数据
新报道的3.6埃电镜结构相比之前4.2埃尽管在数字上看似进步不大,却有着质的飞越。在该结构中,大部分氨基酸的侧链能够被清晰分辨,从而可以据此搭建出准确和完整的结构模型。新的结构揭示了大量新信息,更新了我们对电压门控钙离子通道的认识,比较具有代表性的特征包括:1)该结构展示了一个处于封闭构象的钙离子通道,而四个电压感受器(VSD)都处于去极化状态,因而判断该结构展示的是一个“去活化”的状态;2)辅助性亚基α2σ的结构被基本完整构建,其与离子通道亚基α1的相互作用也完全呈现;3)辅助性亚基α2σ是一次跨膜的蛋白还是膜锚定蛋白在之前一直存有争议,通过新的结构并结合质谱分析,可以判断出α2σ亚基为膜锚定蛋白;4)该结构解析了更为清晰的离子选择性过滤器,在离子选择性过滤器中甚至还可以看到两团相连的密度,很有可能是结合的钙离子;5)通过三维分类,可以得到两个构象不同的结构。对比两个结构可以发现胞内侧的β亚基发生很大的构象变化,该构象变化可能是引起肌肉兴奋-收缩偶联的结构基础。
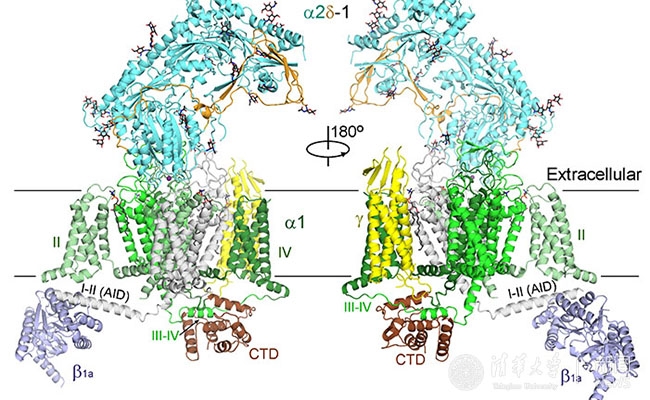
图2:Cav1.1整体三维结构示意图
至此,颜宁教授研究组已经成功解析了肌肉兴奋-收缩偶联通路上的两个关键膜蛋白Cav1.1以及RyR1的结构,从而为理解这一基本生理过程的分子机理打下重要的结构基础。更重要的是,高分辨的Cav1.1结构不仅揭示了Cav通道的结构,也为理解目前仍未有高分辨率结构的真核Nav通道的结构与机理提供了重要的模板,可以利用现有Cav1.1的结构尝试解释此前半个多世纪积累起来的有关Cav和Nav通道的大量生物实验和临床数据,并且为利用结构进行新型药物设计、筛选和优化提供了重要基础。
生命学院CLS项目五年级博士生吴建平、结构生物学高精尖中心卓越学者闫浈以及生命学院CLS项目二年级博士生李张强为本文共同第一作者;生命学院二年级博士生钱兴洋在轮转期间参与该课题实验;医学院周强副教授为数据处理提供了建议和帮助。北京生命科学研究所董梦秋研究员和卢珊参与质谱鉴定的合作。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)、联想高性能计算、以及荣之联董事长王东辉先生的支持。颜宁教授为本文通讯作者,她是清华-北大生命科学联合中心研究员、膜生物学国家重点实验室成员、拜耳讲席教授,本工作获得科技部重大科学研究计划专项和基金委创新群体支持。





