脯氨酰4-羟化酶(prolyl 4-hydroxylases, P4Hs)介导的蛋白质羟基化是一类重要的蛋白质翻译后修饰。根据底物的不同,P4Hs分为羟基化缺氧诱导因子HIF的HIF-P4Hs(PHD)家族和羟基化胶原蛋白的C-P4Hs家族(Collagen-P4Hs, C-P4Hs)。PHDs羟基化HIF并调控HIF蛋白的动态平衡,是细胞感知氧气的分子基础,对该现象的揭示获得了2019年诺贝尔生理与医学奖。除此而外,PHDs家族还被报导了多种底物,包括AKT、P53等等,从而广泛地参与细胞内各种重要事件。然而,相比于PHDs,C-P4Hs的非胶原底物以及生物学功能在很大程度上仍报导较少。并且,C-P4Hs被报导在多种肿瘤中上调表达,其新的底物和功能有待深入揭示。
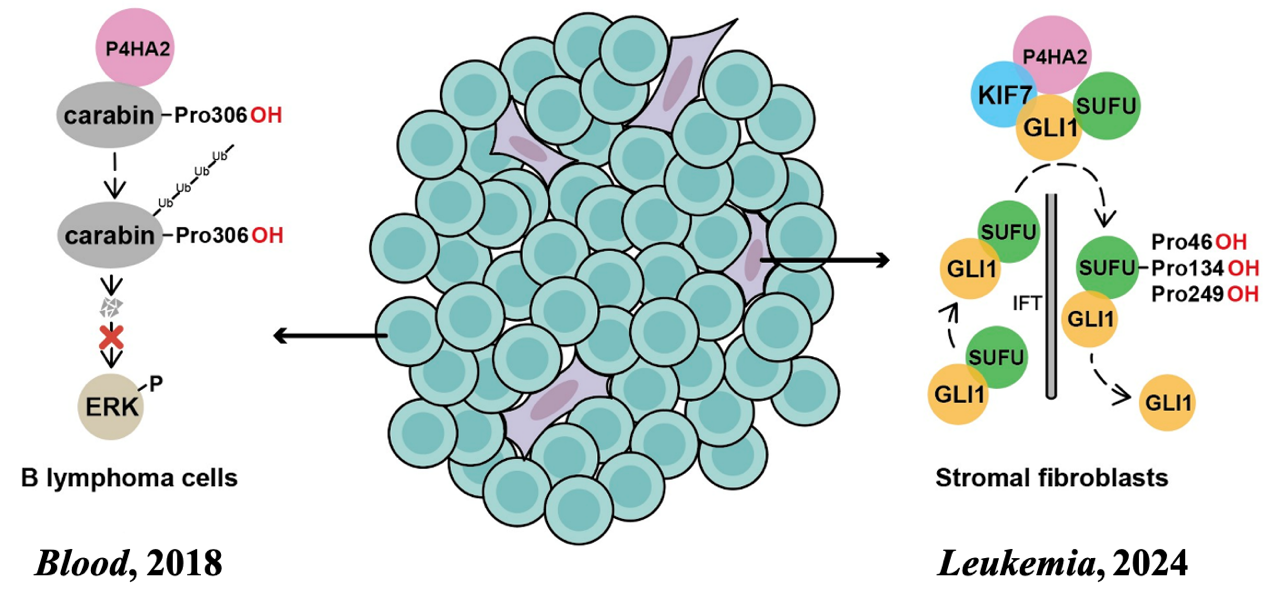
复旦大学蒋维联合重庆医科大学党永军团队一直致力于肿瘤新靶点的发现和干预研究,尤其是C-P4Hs新底物的鉴定及活性分子的发现。该团队在2018年于Blood期刊报导了P4HA2在弥漫性大B细胞淋巴瘤(DLBCL)中显著上调表达,通过羟基化免疫负性调节蛋白Carabin,促进其泛素化降解并解除对ERK信号的抑制,促进DLBCL的发生发展。同时,作者们观察到P4HA2除了在部分肿瘤细胞中上调外,还在几乎所有的肿瘤相关成纤维细胞中高表达,底物Carabin仅在B淋巴瘤细胞中表达。那么,肿瘤相关成纤维细胞中的P4HA2是否参与该酶促淋巴瘤发生发展的功能?在肿瘤相关成纤维细胞中是否存在P4HA2除胶原以外新的底物和新的作用机制?
2024年6月23日,复旦大学基础医学院蒋维联合重庆医科大学药学院党永军团队在Leukemia上发表了题为“P4HA2 hydroxylates SUFU to regulate the paracrine Hedgehog signaling and promote B-cell lymphoma progression”的研究论文,揭示了P4HA2调控Hedgehog信号转导并促进B淋巴瘤的新机制。

该研究首先通过串联亲和纯化偶联质谱技术(TAP/MS)鉴定了P4HA2的相互作用蛋白,发现Hedgehog信号通路中的核心成员KIF7与P4HA2具有较强的互作。作者进而观察到,敲除P4HA2的细胞中Hedgehog的信号转导被显著抑制。多种体外实验证实了P4HA2与KIF7存在强烈的直接结合,并且与Hedgehog信号转导复合物中其他组分(GLIs和SUFU)也存在非直接互作。作为动态复合物的核心成员,KIF7在Hedgehog通路激活时迁移至纤毛顶端。高分辨率免疫荧光染色显示,P4HA2与KIF7在细胞内共定位,并在Hedgehog通路激活时共同迁移至纤毛顶部。通过回复实验,作者发现P4HA2对Hedgehog信号转导的调控依赖于其羟基化酶活。然而,KIF7并不是P4HA2的底物。通过比较KIF复合体中的各组分,作者发现SUFU是P4HA2调控Hedgehog信号转导的直接底物,并通过质谱检测与点突变体验证SUFU的羟基化位点及功能。此外,作者在野生型和P4ha敲除小鼠中构建了B淋巴瘤原位模型。P4ha2在肿瘤相关成纤维细胞中的缺失显著延缓了肿瘤的增长,并延长了小鼠的生存期。共培养实验提示,P4ha2主要通过调控基质细胞的Hedgehog信号转导,促进Hedgehog下游生长因子的分泌,旁分泌靶向肿瘤细胞并导致肿瘤细胞的恶性增殖。最后,作者对B淋巴瘤临床样本进行了分析,在高级别肿瘤样本中,肿瘤相关成纤维细胞P4HA2的表达与Hedgehog信号存在显著的相关性。
综上所述,该研究通过生物化学等多学科手段揭示了P4HA2是新的Hedgehog信号转导调控因子,P4HA2和KIF7紧密互作,该复合物应答于Hedgehog激活信号转运至纤毛顶端,羟基化底物SUFU来促进Hedgehog信号转导。并且,该项研究揭示了P4HA2在肿瘤相关成纤维细胞中调控Hedgehog旁分泌信号来促进B淋巴瘤进展的机制。结合该团队2018年的发现,这些研究工作较为完整地揭示了P4HA2在B淋巴瘤中促肿瘤发生发展的不同角色,奠定了P4HA2作为抗肿瘤全新潜在靶点的理论基础。团队后续工作仍致力于P4HA2新底物新功能的发现,并针对C-P4Hs缺乏特异抑制剂的现状,已发展多种策略进行C-P4Hs新型抑制剂开发。
复旦大学基础医学院生化系代谢分子医学教育部重点实验室李全福、刘祎飏、重庆医科大学基础医学院副教授巫静娴为本文的共同第一作者。复旦大学基础医学院生化系代谢分子医学教育部重点实验室青年研究员蒋维、重庆医科大学药学院教授党永军为本文的共同通讯作者。本研究还得到了中国科学院分子细胞科学卓越创新中心研究员赵允、研究员姜海,中国科学院上海药物所研究员谭敏佳、副研究员翟琳辉,浙江大学基础医学院研究员黄海,复旦大学附属肿瘤医院研究员徐彦辉、副研究员杨慧蓉的大力支持。





