肿瘤细胞、邻近免疫细胞和各种免疫细胞类型之间的复杂相互作用涉及通过代谢和免疫信号连接的复杂“竞争-合作模式”,这对形成免疫抑制肿瘤微环境(TME)至关重要。在难治三阴性癌症(TNBC)中,这种代谢失衡、免疫抑制性微环境发挥着至关重要的作用,导致疾病的不良预后。靶向上述竞争-合作模式可以有效逆转免疫功能障碍微环境,进而促进癌症三阴性治疗的免疫疗法。然而,细胞相互作用网络表现出高度的灵活性和可塑性,跨多种细胞类型协调调节才可能重塑整体网络。近日,复旦大学药学院蒋晨教授团队设计了一种基于细菌外膜囊泡(OMV)的多模块递释系统,通过独特地利用电荷反转聚合物的性质来实现功能分离,用于特异性靶向恶性细胞和免疫细胞,以定向调和基于代谢免疫串扰的关系,恢复免疫细胞抗肿瘤活性。相关成果以Reconciling the Cooperative-Competitive Patterns Among Tumor and Immune Cells for Triple-Negative Breast Cancer Treatment Using Multimodule Nanocomplexes为题,在线发表于国际期刊《先进材料)(Advanced Materials)。
基于代谢-免疫串扰的“合作-竞争模式”
恶性增殖肿瘤细胞战略性地重新编程其代谢,以从TME中掠夺必需营养素并释放各种代谢产物,从而影响TME的状态。这种对浸润免疫细胞施加的代谢压力导致免疫细胞基于代谢的功能改变。
最近的证据表明,肿瘤相关巨噬细胞(TAMs)占TNBC浸润免疫细胞的50%,在代谢应激下被诱导上调精氨酸酶-1(Arg-1),并向免疫抑制M2表型分化。更为复杂的是,肿瘤细胞还过度表达抗吞噬细胞信号CD24,与M2 TAMs建立了“不要吃我”的合作关系,以逃避免疫杀伤作用。此外,考虑到精氨酸在免疫细胞功能中的关键作用,各种免疫细胞类型之间已经出现了对这种必需营养素的竞争。Arg-1表达升高为特征的M2型TAM,显著消耗精氨酸,从而阻碍T细胞的精氨酸依赖性激活并抑制其抗肿瘤功能。上述合作和竞争的相互作用模式通常有助于整体肿瘤促进TME状态。因此,靶向这种基于代谢免疫串扰的相互作用为抑制肿瘤发展提供了一种有前景的治疗干预策略。
然而,涉及肿瘤和免疫细胞的复杂细胞相互作用网络表现出高度的灵活性和可塑性,需要跨多种细胞类型进行协调调节,以重塑竞争-合作模式。在这些概念的基础上,作者旨在开发一种递送系统,该系统集成了多种调节模块,同时保持功能分离,从而能够精确调节不同的细胞状态。
递送系统设计与定向干预策略
源自细菌外膜的外膜囊泡(OMV)是一种强大的免疫反应增强剂,携带来自细菌的抗原和病原体相关分子模式(PAMPs)。作为完整的纳米级脂质双层囊泡,OMV已应用于各种联合免疫疗法。据报道,片段化OMV也可通过病原体相关分子模式激活免疫系统。受此启发,作者提出了一个基于OMV的递送系统构想,即通过内部货物的物理化学变化诱导OMV碎裂和分离。这一构想旨在利用OMV片段及其内部货物特异性靶向TME中的不同细胞类型,最大限度地协调免疫细胞之间的相互作用,并引发抗肿瘤免疫反应。
因此,作者设计了对异常肿瘤代谢诱导的酸性环境响应的电荷反转纳米复合物,并将其封装在工程化OMV中,形成多功能多模块智能递释系统(charge-reversal polymer/siRNA@CD24 scFv-OMV/PTX nanocomplexes, CR/si@ab-OMV/PTX nanoparticles (NPs))。在pH值降低的触发下,内部纳米复合物的表面呈正电性,破坏外部囊泡结构。工程化的OMV表面富含CD24抗体,可以引导膜片段和插入其中的疏水性化疗药物进入肿瘤细胞。因此,肿瘤细胞被杀死,缓解TME中的代谢应激,并影响TAMs中Arg-1的表达。暴露的正电纳米复合物通过修饰的甘露糖特异性靶向M2巨噬细胞,并递送siRNA以沉默Arg-1。
TAM重新极化为M1型,“不要吃我”的信号被抗体阻断,从而增强肿瘤的巨噬细胞吞噬作用。此外,由于TME中L-精氨酸的增加,有效T细胞的功能将恢复,在抗肿瘤免疫中与复极化的TAMs形成抗肿瘤合作关系。激活的免疫系统与肿瘤细胞进行生存竞争,从而抑制肿瘤增殖。总的来说,CR/si@ab-OMV/PTX-NP可以在降低pH的简单条件下实现多靶点和多功能模块的同时和特异性递送,在TNBC模型中显示出调和恶性细胞和免疫细胞之间的竞争合作模式以及激活抗肿瘤免疫反应的巨大潜力。
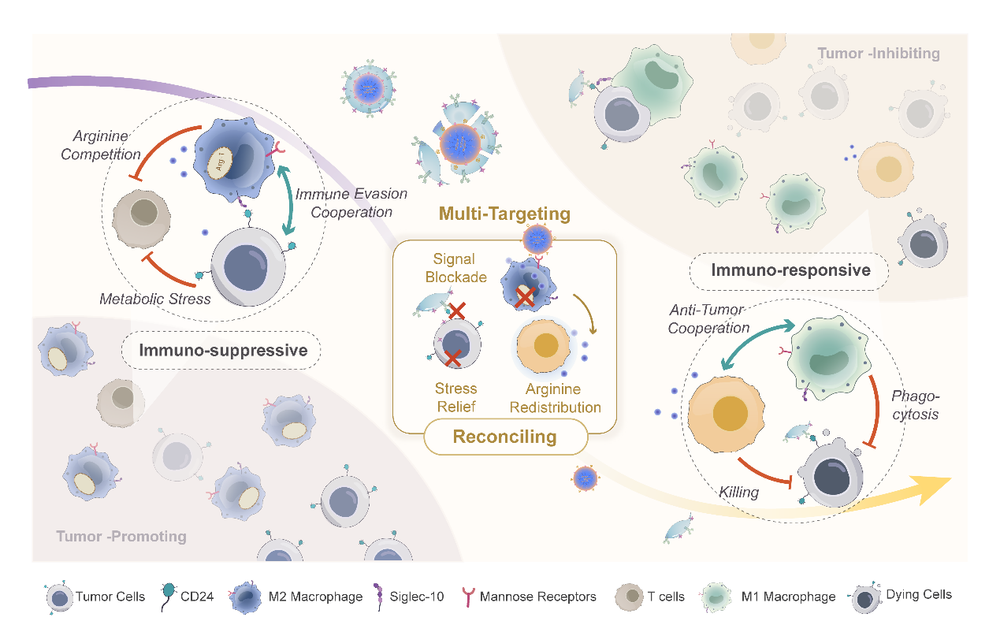
图1 多模块递释系统干预肿瘤和免疫细胞之间合作竞争模式的示意图
在开发多模块递释系统时,作者以OMV为基础,因为工程化囊泡不仅可以作为完整的具有靶向性的载体,还可以作为碎片化的免疫佐剂。据作者所知,这是将电荷反转复合物与OMV的首次结合。其它递送系统报道中往往将OMV作为完整脂质载体使用,而非单独的功能模块。尽管OMV的响应性破裂已经被证实,但还需要进一步地工作来更好地确定内部纳米粒电荷反转后囊泡破裂的机理。
作者在体内和体外验证了该复合物的治疗概念,并对其免疫激活机制提供了初步见解。作者表明,对免疫细胞之间的代谢调节,对肿瘤与免疫细胞之间的免疫信号调节,以及对肿瘤的杀伤,都是重塑免疫响应性相互作用策略的关键点。因此,本研究中的定向靶向战略,CR/si@ab-OMV/PTX-NP可能是一种安全有效的TNBC治疗方法,专门用于调节肿瘤和免疫细胞。
课题组博士研究生(卓博计划学员)李绪雯、博士研究生郭沁为论文的共同第一作者,蒋晨教授为论文的通讯作者。





