细胞中的蛋白质翻译是一项基本的生物学过程,它将RNA中的遗传信息转化为功能性蛋白质,从而实现细胞的正常功能和活动。在这一过程中,翻译的起始阶段被认为是至关重要的,因为它涉及大量能量和时间。在真核细胞中,这一过程始于43S前起始复合物(PIC)的组装,其中包括40S核糖体、eIF1、eIF1A、eIF3复合物、eIF5以及eIF2三聚体复合物(TC)。在正常的生长条件下,这一过程能够顺利进行,确保了蛋白质的正常合成和细胞的正常功能。然而,在面对外界压力或应激条件时,细胞会采取各种机制来抑制翻译的起始过程,以适应不同的环境条件。尽管我们已经了解到了一些抑制翻译的机制,但还有许多详细分子机理仍然不清楚。
2024年4月19日,复旦大学生物医学研究院程净东课题组在Cell Research在线发表了题为“Human tumor suppressor PDCD4 directly interacts with ribosomes to repress translation”的研究论文。在这项最新的研究中,他们聚焦于一类重要的肿瘤抑制因子——PDCD4,并详细阐明了其在翻译调控过程中发挥的新作用机制。

该研究发现,在正常细胞中,PDCD4主要位于细胞核,但在面对压力刺激时会迁移到细胞质中。通过蔗糖密度梯度离心,他们观察到在饥饿条件下,转移到细胞质中的PDCD4主要与40S核糖体结合。为了探究PDCD4抑制翻译的机制,他们使用了四环素诱导的PDCD4-Flag蛋白作为诱饵,并从HEK293细胞中纯化了内源PDCD4与核糖体复合物。通过单颗粒冷冻电镜分析,解析了PDCD4与核糖体的三种不同结构,分别命名为PDCD4-40S、PDCD4-eIF3G-40S和PDCD4-43S。在这三种复合物结构中,研究人员发现PDCD4的N端片段(第100-145个氨基酸)位于mRNA进入通道内,因此将其称为核糖体结合区(RBR)。进一步的结构分析表明,PDCD4的RBR区域通过占据mRNA进入通道,通过阻止eIF1A和TC复合物的结合来抑制43S PIC的进一步组装。此外,他们还发现了PDCD4的C端MA3结构域与mRNA进入位点上方的一个eIF4A结合,从而使eIF4A处于抑制状态,进而抑制了eIF4F复合物的组装。最后通过点突变验证,研究人员进一步验证了这些关键结合区域和作用机制。
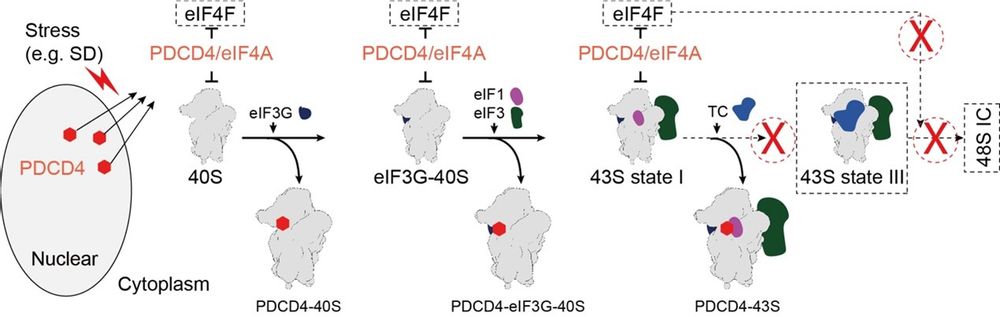
基于这些发现,研究人员提出了PDCD4在抑制翻译起始中的功能模型。在这一模型中,PDCD4通过其RBR结构域占据40S核糖体的mRNA进入通道,从而阻止起始复合物的形成。总的来说,这项研究为我们理解蛋白质翻译调控的机制提供了新的视角,对于深入探究细胞内生物学过程的调控机制以及相关疾病的发生和发展具有重要意义。
该研究的共同第一作者为复旦大学生物医学研究院博士研究生叶显雯和黄子轩,通讯作者为程净东研究员。程净东课题组依托复旦大学生物医学研究院和附属闵行医院,长期致力于翻译调控的分子机制研究。
原文链接:https://www.nature.com/articles/s41422-024-00962-z





