2024年2月29日,复旦大学基础医学院/上海市重大传染病和生物安全研究院陆路、姜世勃,复旦大学药学院刘泽众团队在Cell Reports Medicine 杂志上发表了题为“Neutralization of SARS-CoV-2 BA.2.86 and JN.1 by CF501 adjuvant-enhanced immune responses targeting the conserved epitopes in ancestral RBD”的研究论文。该研究利用团队研发的创新佐剂,成功激发了原始新冠病毒RBD中的保守表位,产生了广谱中和抗体,对当前最新的变异株均表现出强效的中和作用,进一步验证了团队提出的“以不变应万变”疫苗研发策略的可行性。

新冠病毒不断的变异逃逸了之前大部分研发的中和抗体。研究发现,靶向RBD蛋白的SA55、BN03抗体对目前流行的包括BA.2.86在内的多种变异株仍可产生强效的中和作用。然而,通过疫苗免疫诱导产生的中和抗体大部分为疫苗抗原特异性的抗体,较难诱导产生高滴度的SA55、BN03类广谱中和抗体,从而造成病毒逃逸。在HIV和流感疫苗的研发中也同样面临这种难题。因此如何有效强化弱势保守表位的免疫应答,产生广谱中和抗体成为研发广谱疫苗的瓶颈之一。
该研究收集了免疫原始SARS-CoV-2 RBD-Fc二聚体蛋白和团队研发的新型STING激动剂佐剂CF501的恒河猴血清,系统评估了免疫后恒河猴血清对XBB.1.5、XBB.1.16、CH.1.1、EG.5、BA.2.86和JN.1变异株的中和活性。研究结果表明,即使JN.1等毒株在RBD蛋白上出现了大量的突变,辅以CF501佐剂的原始新冠病毒RBD-Fc在恒河猴体内仍能产生针对这些变异株的广谱且强效的交叉中和抗体。SA55和BN03抗体被证实是目前最具广谱且强效的中和抗体,可有效中和包括BA.2.86和XBB系列变异株。进一步研究发现,CF501佐剂可有效增强与SA55、BN03和S309具有相似表位的广谱中和抗体的产生,从而发挥广谱的中和活性。
此外,该研究还观察到,在接种了两剂量疫苗后,恒河猴血清中产生的中和抗体主要是针对原始毒株的,对其他变异株的交叉中和抗体产生较少。然而,第三次免疫后,在CF501佐剂的作用下,针对原始毒株的中和抗体水平未见显著提高,但却显著增加了针对保守表位的交叉中和抗体。这表明,在强效佐剂的作用下进行加强免疫可以有效提升疫苗的广谱性。
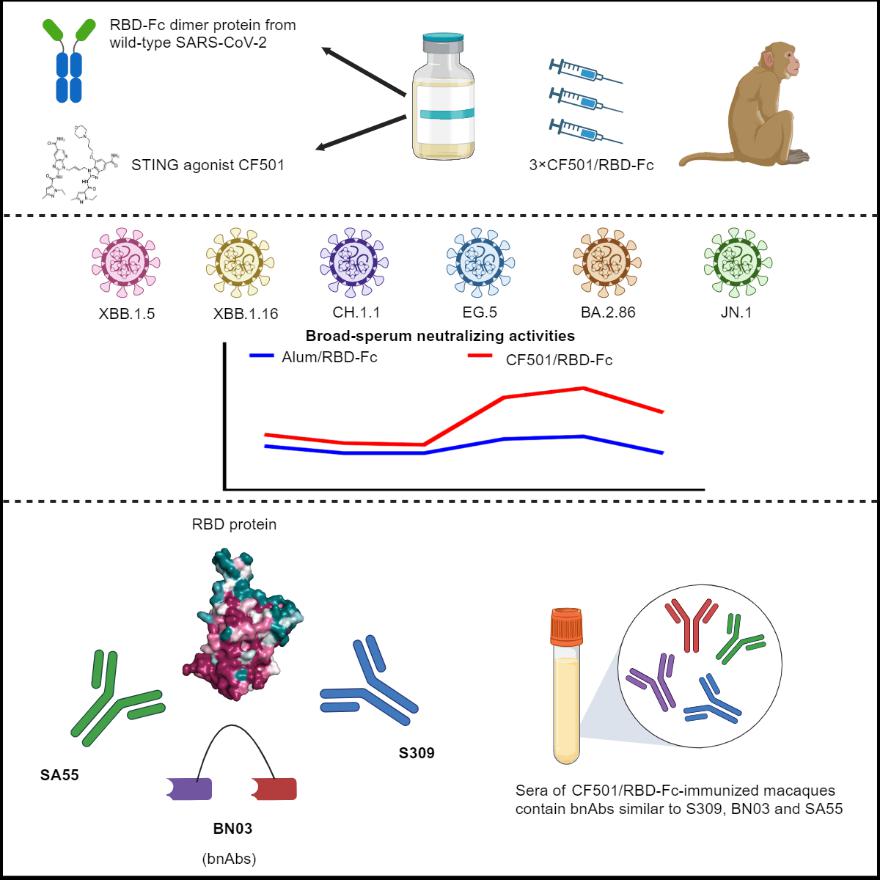
CF501/RBD-Fc疫苗诱导广谱的中和抗体应答
复旦大学青年研究员刘泽众、博士研究生周洁为本文共同第一作者;复旦大学基础医学院研究员陆路、教授姜世勃,复旦大学药学院青年研究员刘泽众为本文的通讯作者。
原文链接https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00068-5





