SARS-CoV-2将与人类长期共存,尤其是对老年人和有基础病患者等弱势群体有巨大威胁,使得迫切需要在病毒基因组中鉴定潜在的新药物靶标以开发新的治疗方法。核酶(Ribozyme)作为有催化功能的RNA,在基因表达调控分子工具和靶向药物研究领域颇具潜力。根据催化反应类型不同,目前已知的天然核酶中,除核糖体肽酰转移酶、分子间剪切型核酶RNaseP和自剪接型核酶以外,种类最多的是自剪切型核酶,该类核酶通过剪切位点核糖2’-羟基亲核攻击邻近的3’, 5’-磷酸二酯键,产生2’, 3’-环磷酸和5’-羟基剪切产物。其中,锤头型核酶(Hammerhead Ribozyme)长度介于50~150nt之间,是目前长度最短、研究最彻底、已知生化性质和结构参数最完备的自剪切核酶。
2024年1月31日,复旦大学生物医学研究院Alastair Murchie/陈东戎课题组在期刊Nucleic Acids Research上发表题为“Identification of Hammerhead-variant ribozyme sequences in SARS-CoV-2”的研究论文,组运用RNABOB生物信息学方法在SARS-CoV-2中鉴定出39个锤头型核酶变体序列(Hammerhead-variant Ribozyme Sequences)。

这些序列在SARS-CoV-2基因组中成簇分布,主要集中在ORF1a/b区域,部分序列位于病毒突变和抗病毒药物开发的关键位点,如Spike蛋白编码区。锤头型核酶变体在SARS-CoV-2 Alpha-Omicron等六个病毒突变株中高度保守,在冠状病毒种间则和Bat CoV在进化谱系中最接近。体外分子间剪切验证表明锤头型核酶在Mn2+, Co2+ , Cd2+和Ni2+等金属阳离子条件下具备催化活性,核酶剪切位点和已报道的锤头型核酶一致,剪切依赖温度、pH和金属离子种类与浓度等条件,符合自剪切核酶的一般酸碱催化机制。
此外,SARS-CoV-2基因组RNA复制过程中产生的不连续亚基因组RNA (Sub-genomic RNA)是该病毒翻译得到结构蛋白和装配蛋白的重要中间体,生物信息学分析结果表明部分SARS-CoV-2锤头型核酶变体的剪切位点和SARS-CoV-2非经典亚基因组RNA断裂-连接位点重合,表明核酶的剪切可能对SARS-CoV-2细胞内的RNA复制、基因组装配等活动产生重要影响。
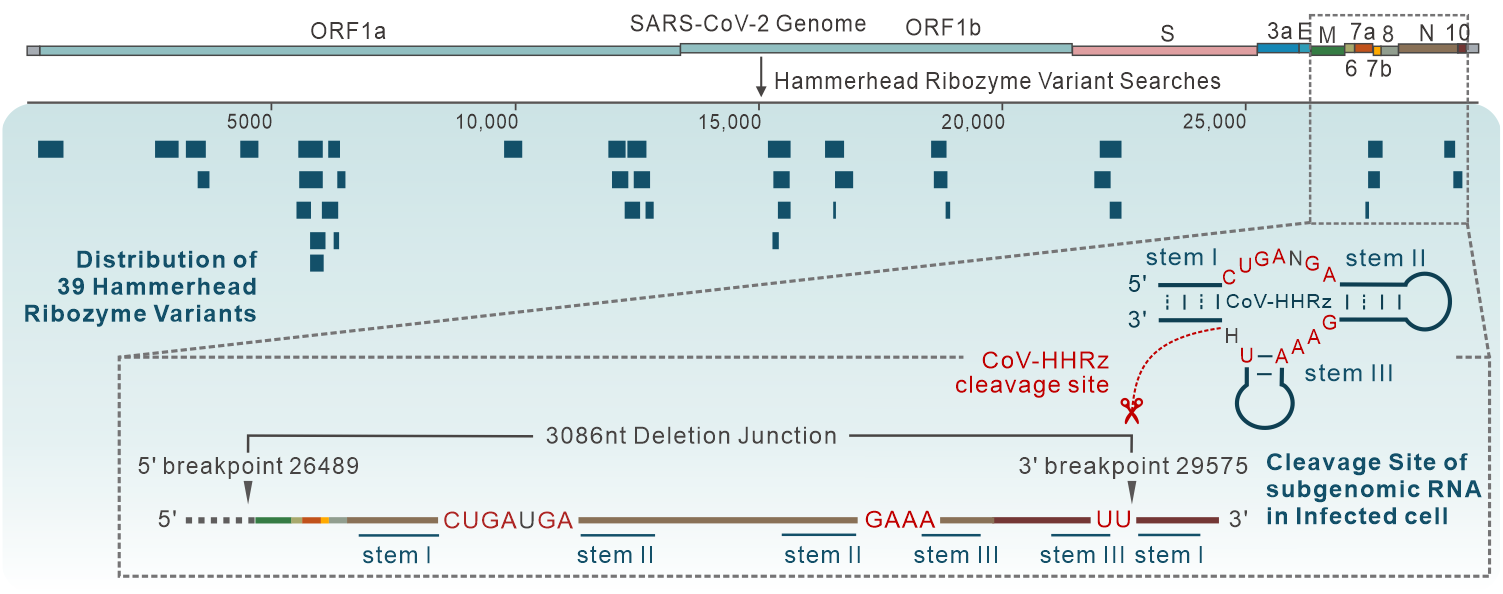
该研究首次揭示了SARS-CoV-2基因组中的天然核酶及其所具备的体内、外RNA自剪切催化活性,为开发针对多种SARS-CoV-2突变株的广谱治疗手段提供了新的RNA靶标,同时为核酶催化活性的干预为治疗长期新冠提供了新思路。
该研究主要由复旦大学生物医学研究院博士后刘格彤完成,Alastair Murchie、陈东戎为共同通讯作者。





