近日,复旦大学附属肿瘤医院大肠外一科徐烨教授联合精准肿瘤中心胡欣教授,成功绘制出迄今国内最大规模的结直肠癌基因组变异图谱,揭示了中国人群结直肠癌基因组变异特征,并鉴定出其中可精准预测结直肠癌靶向治疗和免疫治疗疗效的基因组标志物,为结直肠癌的基础临床转化拓宽了思路。相关研究成果日前在国际权威学术期刊《胃肠病学》发表。

高化疗耐受、易复发转移
结直肠癌精准治疗方案亟需优化
结直肠癌是严重威胁我国居民生命健康的恶性疾病。“随着居民生活方式的变化和健康筛查意识的提升,我国结直肠癌发病人数越来越多”,徐烨教授表示,“然而,高化疗耐受和高复发转移率仍是阻碍结直肠癌患者获得长期生存的‘瓶颈’,约20-25%的患者在初诊时即伴随转移,另有30%的I-III期和65%的IV期患者出现复发或二次转移。由于结直肠癌复杂的分子发病机制,致使其具有高度的肿瘤异质性。因此,寻找结直肠癌个体化肿瘤靶标,探索结直肠癌的精准治疗,对于打破结直肠癌治疗‘瓶颈’具有重要临床转化价值。”
目前,以分子免疫治疗、靶向治疗等治疗方式为代表的精准策略已经在结直肠癌研究领域广泛开展。然而,当前相关治疗标准和治疗指南绝大多数参考人群为西方群体,基于中国人群的结直肠癌基因组变异特征图谱仍然处于“空白”状态。
为此,复旦大学附属肿瘤医院大肠外一科主任徐烨教授联合精准肿瘤中心副主任胡欣教授,展开了基于中国人群的大规模结直肠癌特异性多基因检测队列研究。
探索化疗敏感性差的“谜题”
绘制迄今国内最大规模结直肠癌基因组变异图谱
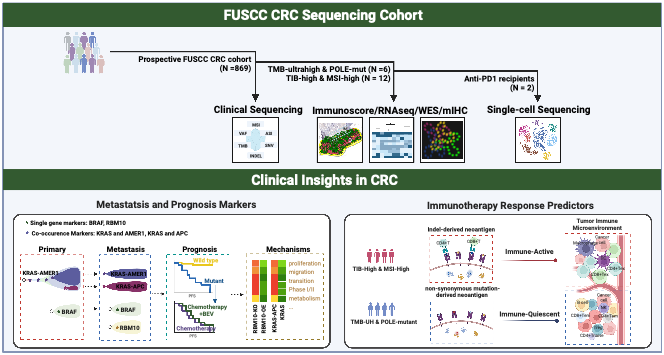
该研究基于中国人群结直肠肿瘤的前瞻性队列,纳入了869例结直肠癌患者,其中包括586例早期和283例晚期结直肠癌。利用887基因Panel测序,绘制体系和胚系变异图谱,描述了中国人群结直肠癌临床病理和基因组变异特征。这也是迄今国内最大规模的结直肠癌前瞻性靶向测序平台和临床样本队列。
基因图谱显示,在结直肠癌体系变异方面,突变频率前三位分别为TP53(72%)、APC(63%)和KRAS(42%),癌症信号通路突变图谱与高加索人群相比差异较大,呈现出中国结直肠癌患者群体的独有特征。在胚系变异方面,4.6%的患者携带DNA损伤修复通路相关的明确致病或可能致病性胚系突变,其中27.5%易感基因携带者发生因杂合性缺失或双等位基因变异导致的“二次打击”事件。
此外,研究结果表明,BRAF和RBM10单基因驱动突变是转移性结直肠癌较短无进展生存期的独立预后因素,且体外实验表明RBM10表达缺失促进肿瘤细胞增殖、迁移并抑制凋亡。胡欣教授说:“这可能是导致结直肠癌复发转移的诱因之一。”
基因组变异互作网络分析共获得65个共现和106个互斥潜在功能依赖性事件,其中KRAS/AMER1和KRAS/APC共现突变可加速药物代谢,导致对以化疗为基石的治疗敏感性较差,从而使得患者在进行化疗时临床获益有限。
发现“冷、热”免疫微环境差异
优化结直肠癌免疫治疗疗效预测机制
团队发现,联合基因组标志物可优化免疫治疗疗效预测,且这种预测在本中心免疫检查点抑制剂治疗队列中得到验证。
微卫星高度不稳定且插入缺失变异高负荷的肿瘤,在接受免疫治疗后完全退缩,展现‘热’免疫微环境特征,其高免疫原性肿瘤新抗原经MHC-II复合物递呈给CD4+ T细胞而激活细胞毒效应。相反,POLE功能性突变携带者接受免疫治疗后,疾病发生进展,尽管有极高的肿瘤突变负荷,但大量由非同义单核苷酸变异衍生新抗原的递呈功能缺陷并多发耗竭,伴随相对较少活化淋巴细胞浸润、免疫检查点表达及PD-1/PD-L1共定位等,整体呈现相对“冷”免疫表型。
“这一发现提示我们可以据此优化预测免疫治疗疗效的基因组标志物,更精准识别获益人群,为广大结直肠癌患者的精准诊疗提供新希望”,徐烨教授表示。
该研究论文的共同第一作者为复旦大学附属肿瘤医院国琳玮博士、王云锦博士和杨闻箫硕士。





