恶性黑色素瘤常常以“恶变的痣”为人所知,由于其恶性程度高,晚期缺乏有效治疗方案,素有“癌王”之称。近日,复旦大学附属肿瘤医院骨与软组织外科副主任、恶性黑色素瘤中心主任陈勇教授领衔团队,联合中国科学院上海有机化学研究所王婧研究员、俞飚院士研究团队,首次报道了具有明确靶向机理、高效特异的恶性黑色素瘤关键致癌因子MITF小分子抑制剂,使恶性黑色素瘤精准靶向治疗新突破取得。
相关研究成果“特异靶向恶性黑色素瘤关键转录因子MITF的小分子化合物研发”,日前在权威学术期刊《细胞研究》发表。
关键因子“不可靶向”,恶性黑色素瘤精准治疗陷困局
恶性黑色素瘤起源于黑色素细胞,是最难以治疗的恶性肿瘤之一。外科手术是早期患者获得根治的主要手段,但晚期的患者常常因缺少有效治疗药物,生存状态不佳。即便使用更为精准的靶向治疗方案,但90%的靶向治疗患者会在治疗5~7月后出现耐药性。陈勇教授介绍说,解决这一困境的关键在于寻找高效的恶性黑色素瘤治疗靶点,进而结合免疫、靶向方案提高治疗响应率,降低复发率。
既往研究显示,MITF(Microphthalmia transcription factor)是恶性黑色素瘤发生、转移发挥关键作用的转录因子,同时也是黑色素瘤最为重要的直系致癌基因,被认为是治疗恶性黑色素瘤最具突破可能的靶点之一。
在肿瘤治疗中,靶向治疗方案必须先要寻找到可以精准定位的“靶子”。MITF虽然是极为理想的“靶子”,然而,由于缺少配体结合“口袋”,长期以来MITF被认为是“不可靶向的”,直接、高效、特异靶向MITF的小分子化合物既往并没有被报道过。
发现小分子化合物,可有效抑制肿瘤活性
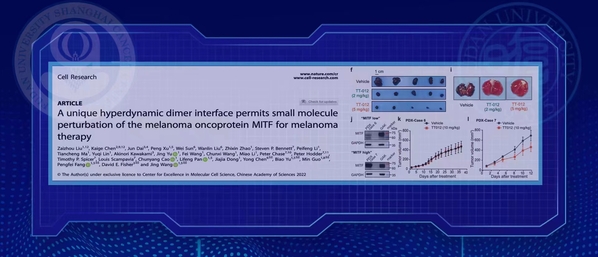
基因层面的研究证实,MITF的功能发挥依赖于其二聚体“亮氨酸拉链”的形成。通过对MITF功能缺失导致的白化病突变进行分析,研究团队发现该二聚体具有独特的动态不稳定性且对内外干扰非常敏感,并由此提出了小分子破坏MITF二聚体形成来特异性抑制MITF的靶向机制。
基于上述机制,研究团队进一步发现了小分子化合物TT012,可以在生化和细胞水平高效破坏MITF的二聚体形成。此外,该小分子化合物还能在全基因组水平特异抑制MITF的转录活性。随后,研究团队通过动物模型对该小分子化合物进行验证,结果显示在多种动物模型中,对MITF高表达的恶性黑色素瘤表现出良好肿瘤抑制活性。
“这意味着小分子化合物TT012有望成为恶性黑色素瘤的潜在靶向新药,”陈勇教授说,“这也是肿瘤学界首次研发了具有明确靶向机理,高效特异的MITF小分子抑制剂。未来我们还将通过更多研究和临床试验,来证实该小分子抑制剂在恶性黑色素瘤的精准治疗价值。”
该项研究成果在《细胞研究》杂志在线发表(https://doi.org/10.1038/s41422-022-00744-5),小分子化合物TT012获美国专利授权一项(US 11077097B2)。
Sanford Burnham Prebys医学研究所主任齐夫·罗奈教授对该研究的进行亮点点评。他写道,“这项研究代表了黑色素瘤靶向治疗的重要进展,新发现的化合物可能具有重要的临床意义。鉴于关键调控基因的遗传扰动在癌症中很常见,目前的研究可能还具有超越MITF的重要意义。”(https://doi.org/10.1038/s41422-022-00762-3)
专家提示:异常黑痣莫轻心,当心黑色素瘤来袭
陈勇教授表示,恶性黑色素瘤常见的形态就是体表的“黑痣”,因而也容易被认为是痣。但需要注意的是,人体多数的色斑和痣都是良性的,当有些“痣”出现不对称、边界不清晰、颜色深浅不一、直径超过5毫米或者短期内出现破损等症状,就要需要提高警惕,及时到正规医院就诊,以排除恶性黑色素瘤的可能。
有人出于美容等原因,希望将痣去除,对此,陈勇教授建议不要进行非正规的“点痣”,应当去正规医院手术切除,并且进行病理检查,避免因“点痣”错过发现恶性黑色素瘤的机会。





