先天性心脏病是全球发病率和死亡率居首位的出生缺陷,是5岁以下儿童死亡的首要原因。法洛氏四联症(TOF)是重症先天性心脏病之一并常伴有紫绀表型,由于发病机制不明,TOF的防、诊、治面临重大的挑战,尤其是随着“二孩”和“三孩”政策全面实施后,预计因高龄、高危孕妇比例增加等原因,TOF在很长一个时期内可能维持高发甚至上升趋势。
TOF的表型复杂,其发生过程中涉及多种心脏发育信号的失调。MicroRNA作为一种参与表观调控的非编码单链RNA分子,成熟miRNA协调着胚胎发育中众多关键过程,包括许多心脏发育相关基因的表达,在心脏发育中扮演重要角色。尽管国内外研究者在TOF病人中发现了许多差异表达的microRNA,但这些microRNA的生理功能以及在TOF复杂表型形成中的作用仍然未知。
近日,复旦大学附属妇产科医院王红艳教授团队和复旦大学生命科学学院赵健元研究员合作研究发现,在人胚胎发育早期,miR-222通过表观抑制microRNA成熟中负责第二步的关键酶DICER1和AGO2表达,阻滞心脏microRNA的成熟加工并诱发TOF。
2022年5月30日,研究成果以“Master MicroRNA-222 Regulates Cardiac MicroRNA Maturation and Triggers Tetralogy of Fallot”为题在线发表于Signal Transduction and Targeted Therapy。
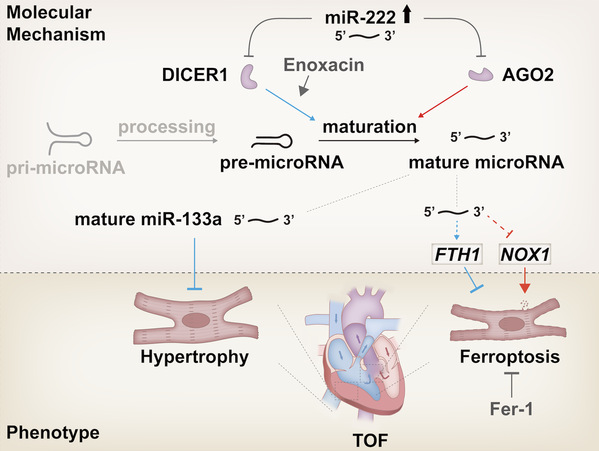
图1. miR-222诱发法洛氏四联症的分子机制
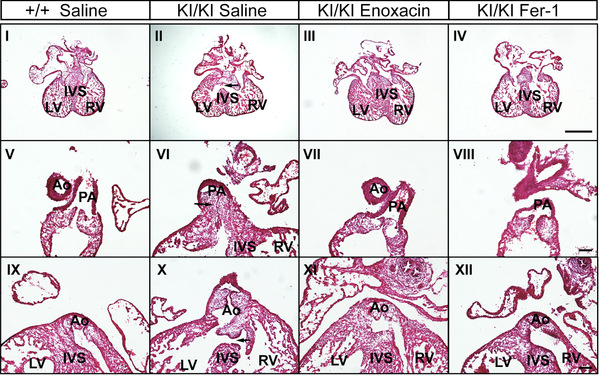
图2. 促进miRNA成熟的依诺沙星(enoxacin)或铁死亡抑制剂铁抑素(Fer-1)能显著降低miR-222诱导的法洛氏四联症发生风险
研究人员在临床样本中发现,人胚胎发育早期心脏中miR-222表达的异常升高与TOF的发生相关;进一步利用基因编辑构建胚胎心脏专一性miR-222过表达小鼠模型后,发现miR-222的高表达可导致小鼠心脏出现TOF中的各类表型,包括室间隔缺损、主动脉骑跨、肺动脉狭窄和右心室心肌肥大,该结果不仅证实了临床发现中miR-222与TOF的因果关系,也是国际上首个通过编辑microRNA获得的TOF动物模型。在分子机制探索中,研究人员结合高通量筛查和分子细胞生物学分析发现,miR-222特异性抑制microRNA合成中关键酶DICER1和AGO2的表达,进而控制着全细胞水平成熟microRNA生成量。在具体致病通路的解析中,研究人员揭示了水平升高的miR-222通过DICER1-AGO2轴向下调miR-133a致心肌肥厚;miR-222增加细胞的氧化压力诱发铁死亡进而导致TOF形成。心肌肥厚和铁死亡增强等表型能够被miR-122抑制剂、增加DICER1或者AGO2所逆转(图1)。特别有趣的是,在模型小鼠中使用促进miRNA成熟的依诺沙星(enoxacin)或者铁死亡抑制剂铁抑素(ferrostatin-1)能够极为显著地降低各类TOF表型和阻止TOF发生,展现出精准高效的防控作用(图2)。
该研究提示在microRNA网络中也存在着中枢或主控microRNA(master microRNA),它调节了心脏发育过程中诸多microRNA的时空表达差异性及彼此之间的相互作用,有助于我们理解和解释TOF复杂表型的原因。MicroRNA成熟涉及由pri-miRNA到pre-miRNA的第一步以及由pre-miRNA到成熟miRNA的第二步。既往研究表明决定miRNA成熟中第一步的关键酶DRASHA和DGCR8的遗传性表达失衡直接影响干细胞向三个胚层的分化(Nature,2021),而在胚胎期心脏发育中高表达的miR-222,通过协同抑制miRNA成熟中顺次的第二步关键酶DICER1和AGO2最终导致了严重的心脏畸形TOF表型,这也是在已知miR-222与心衰或者心梗相关联的报道基础上,首次确认miR-222在心脏发育中的主控作用。
复旦大学李超和李红豆博士为本文共同第一作者,复旦大学王红艳教授和赵健元研究员为共同通讯作者,该研究得到了复旦大学发育生物学研究所陶无凡教授、复旦大学附属妇产科医院姚晓瑛主任、南京大学医学院杨中州教授和黄心怡博士、南通大学刘东教授、复旦大学生命科学学院王永明教授、上海实验动物中心赵莹博士的大力支持。
论文链接:https://doi.org/10.1038/s41392-022-00993-1





