被称为“魔法导弹”的抗体药物已广泛应用于临床,但全长抗体在临床应用中面临分子尺寸大所导致的渗透性低等问题。一般认为,通过改造抗体,使用抗体片段等可避免全长抗体的固有缺陷,其中备受瞩目的就是Fab类抗体药物。截止目前,临床上已有多款Fab类抗体药物批准上市,比如治疗老年黄斑性病变患者非常有效的雷珠单抗(Ranibizumab)。尽管如此,Fab类抗体药物的不足之处也很明确,片段化的设计使其稳定性问题成为一项巨大的挑战,后者限制了Fab类抗体药物的应用。
近日,来自复旦大学基础医学院医学分子病毒学教育部/卫健委重点实验室与上海市重大传染病和生物安全研究院的应天雷教授团队和复旦大学附属眼耳鼻喉科医院洪佳旭副主任医师团队尝试工程化改造Fab,开发了具有更强稳定性的新一代人工合成抗体药物平台,并在眼科常见病角膜新生血管和脉络膜新生血管两种模型上验证了其有效性,相关研究成果以长文形式《Design of a novel Fab-like antibody fragment with enhanced stability and affinity for clinical use》发表在Small Methods期刊上(https://onlinelibrary.wiley.com/doi/epdf/10.1002/smtd.202100966)。
研究者人员通过计算机辅助分子设计及同源建模,发现IgG1 CH3-CH3 同源二聚体与CH1-CL异源二聚体间具有高度的结构相似性。与此同时,CH3-CH3同源二聚体界面之间的相互作用远强于CH1-CL异源二聚体界面之间的相互作用。因此,该研究团队将 Fab上的CH1和CL结构域均替换成IgG1 CH3结构域,并选取天然抗体氨基酸序列作为抗体可变区与恒定区CH3之间的连接子,构建成一种全新的人工合成抗体形式(FabCH3)。
为了验证该类新型人工合成抗体的有效性,研究人员选取了特异性针对间皮素(mesothelin)的人源抗体(m912)和已获批上市的针对血管内皮生长因子A(VEGFA)的雷珠单抗(Ranibizumab)进行改造。试验显示,这些新一代的人工合成抗体可在原核系统中高水平表达。研究人员进一步展开了人工合成抗体的稳定性研究。结果显示,与亲本抗体相比,改造后的人工合成抗体的热稳定性(Tm)、长期稳定性以及亲和力都显著增强,表明新一代人工合成抗体具有更良好的稳定性。研究人员利用结构生物学的方法解析了m912 FabCH3和m912 Fab的高分辨率晶体结构,结果显示FabCH3的恒定结构域和互补性决定区具有更多的刚性结构,揭示了FabCH3稳定性和亲和力增强的分子机制。
最后,研究人员分别建立了小鼠角膜和脉络膜新生血管模型,以评估Ranibizumab FabCH3抑制新生血管生成的能力。结果发现,注射Ranibizumab FabCH3均可有效减少上述两种动物模型新生血管的面积和体积,并且效果显著高于Ranibizumab Fab。
总的来说,本研究描述的人工合成抗体(FabCH3)可以作为新一代抗体药物开发的通用平台,用于设计和研发稳定性更高、亲和力更强的新结构抗体药物。本论文的第一作者是复旦大学基础医学院王春雨博士和复旦大学附属中山医院杨振霖博士,复旦大学基础医学院和复旦大学附属眼耳鼻喉科医院是并列第一作者单位,本论文的通讯作者是复旦大学基础医学院应天雷教授、复旦大学基础医学院吴艳玲博士以及复旦大学附属眼耳鼻喉科医院洪佳旭副主任医师。近年来,复旦大学上海医学院大力鼓励基础研究院系与其附属医院合作,围绕临床的痛点问题展开科技联合攻关,以此驱动学科建设与发展,推动前沿医学科技创新研究和成果转化。在后续工作方面,研究团队将积极寻求工业界和产业界转化的可能,以期早日将研究成果应用于临床。
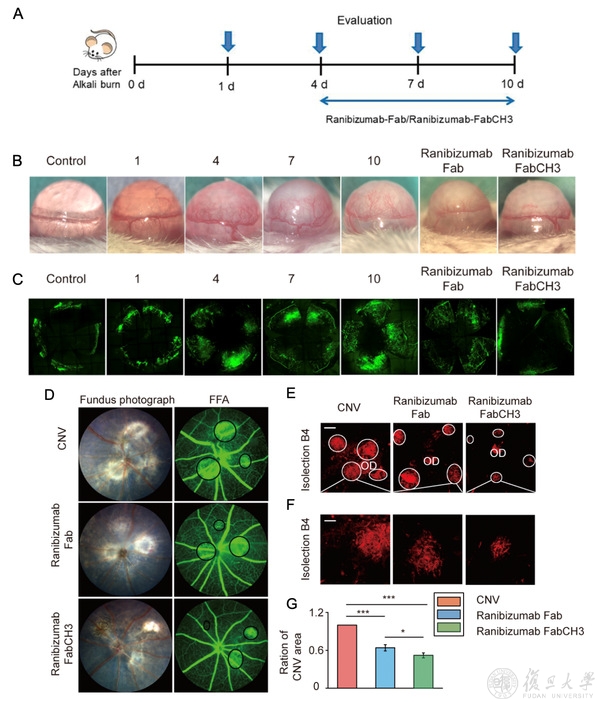
Ranibizumab Fab和Ranibizumab FabCH3在小鼠角膜和脉络膜新生血管模型中的治疗效果

应天雷、洪佳旭团队参与论文工作的部分作者合照





