近日,肝病学领域国际学术期刊Hepatology在线发表了复旦大学基础医学院病原生物学系暨医学分子病毒学教育部/卫健委重点实验室袁正宏/陈捷亮团队题为“Hepatitis B Virus cccDNA Minichromosomes in Distinct Epigenetic Transcriptional States Differ in Their Vulnerability to Damage”的研究论文(DOI: 10.1002/hep.32245)。该研究基于多种体内外乙型肝炎病毒(HBV)微染色体模型,首次系统阐明不同转录活性和表观状态的HBV微染色体在稳定性和抗清除方面存在差异,并由此提出促进HBV基因储存库清除的新对策。
乙型肝炎病毒(HBV)感染引起的慢性乙型肝炎及相关肝病长期危害国民健康。HBV感染肝细胞后,病毒基因组在细胞核形成共价闭合环状DNA(cccDNA)并以微染色体(minichromosome)形式长期存留于细胞核内,由于其不能被现有药物有效清除,被认为是乙肝病毒感染慢性化和难以治愈的重要分子基础。缺乏对HBV cccDNA微染色体存留和清除机制的深入认知,阻碍了新型干预策略的研发。
先前袁正宏课题组和国内外研究发现表观遗传机制在调控cccDNA转录活性中起重要作用,但尚不清楚其对cccDNA稳定性的影响。鉴于此,课题组综合利用HBV感染模型和近年来研发的cccDNA体内外模型,以干扰素(IFN-α)处理和HBx敲除来建立cccDNA转录活性抑制的表征,应用染色质免疫共沉淀、微球菌核酸酶(MNase)敏感性实验和ATAC-seq等技术评价cccDNA的表观修饰特征、可及性(accessibility)和与抗病毒因子的结合情况,以比较不同转录活性和表观状态下的cccDNA在稳定性和抗清除方面的差异。
研究发现,与不处理或野生型病毒相比,IFN-α处理或HBx敲除后HBV cccDNA的转录活性低下,其组蛋白表观修饰呈抑制性状态,开放性和可及性广泛降低。而此种可及性的降低,导致cccDNA与RNA Pol II的结合减少,同时阻碍cccDNA与抗病毒因子APOBEC3A和靶向性CRISPR/Cas9分子的结合,从而显著削弱AOPBEC3A的脱氨基效应和CRISPR/Cas9的切割编辑效应。这些结果提示,转录抑制的cccDNA虽然在病毒RNA和抗原产生能力上有所损失,但具备更强的逃避清除能力。进一步采用重组HBV cccDNA小鼠模型,发现相较正常转录活性的cccDNA,转录抑制的cccDNA在体内的清除速率显著更慢。基于此,研究者提出通过提高cccDNA的可及性以促进其清除的策略,并在细胞模型中进行验证。结果证实,将组蛋白去乙酰化酶抑制剂Belinostat处理含cccDNA的细胞,能上调cccDNA上H3和H4组蛋白的总乙酰化水平并增加cccDNA的可及性,由此提升AOPBEC3A对cccDNA的脱氨基效率。
该研究首次揭示了转录活性和表观调控对HBV cccDNA微染色体稳定性的影响,加深了对cccDNA异质性存留方式和清除机制的认知,为研发靶向清除HBV基因储存库的策略提供了新视角和理论技术支撑。相关工作由国家自然科学基金、国家传染病科技重大专项、中国医学科学院乙肝病毒慢性感染治愈研究创新单元和上海市科技启明星计划等资助。袁正宏研究员和陈捷亮副教授为论文的共同通讯作者,王洋博士为第一作者,李雨檬、宰文静博士和邓强研究员等为共同作者。
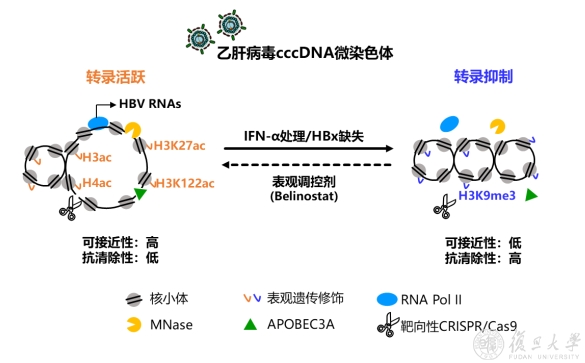
乙肝病毒微染色体逃避清除的表观调控机制示意图

论文链接:https://aasldpubs.onlinelibrary.wiley.com/doi/abs/10.1002/hep.32245





