复旦大学生命科学学院李继喜、附属华山医院陈向军团队在炎性细胞死亡的调控机制方面取得重要进展,发现和鉴定到细胞焦亡的新型调控因子TRIM21。9月11日,研究论文以《TRIM21促进Gasdermin D高聚从而调控细胞焦亡》(“TRIM21 regulates pyroptotic cell death by promoting Gasdermin D oligomerization”)为题发表在《细胞死亡与分化》(Cell Death and Differentiation)杂志上。
细胞焦亡(pyroptosis)是一种高度炎性和裂解性的程序性细胞死亡。作为杀死被感染细胞、释放IL-1家族细胞因子的一种手段,细胞焦亡通路在信号异常时可能导致严重的免疫系统紊乱,包括痛风、败血症等;阿尔茨海默病、帕金森氏病等神经退行性疾病,也与细胞焦亡密切相关。因此,阐明细胞焦亡的调控机制,对于抵抗病毒、细菌等病原体感染,治疗自身免疫性疾病,减缓神经退行性疾病等具有重要意义。
病原体相关分子模式(PAMP)和机体自身衍生的损伤相关分子模式(DAMP)均可通过多种形式激活炎性半胱天冬酶Caspase家族,进而剪切下游蛋白GSDMD,促进其N端(GSDMD-N)高聚并在细胞膜上形成孔洞,诱导炎症因子及其他细胞内容物释放和细胞裂解性死亡,激发强烈的炎症反应。然而,焦亡关键蛋白GSDMD如何高聚,什么因子可以促使其高聚并引起细胞焦亡的动态调控机制并不清楚。
李继喜课题组长期从事细胞死亡的结构基础与调控机制研究。在细胞焦亡领域,通过X-光晶体衍射方法解析了GSDMD-C的精细三维结构,阐明了GSDMD蛋白的自抑制机理(2017,Proc Natl Acad Sci USA);同时也解析了RIPK1/RIPK3坏死小体复合物的高分辨率三维结构(2018,Cell),并发现和鉴定了细胞坏死通路中降解RIPK3的负调控分子TRIM25(2021,Cell Death Differ)。

在本研究中,李继喜/陈向军团队通过高灵敏质谱分析,筛选并鉴定到GSDMD的结合蛋白TRIM21,并证明TRIM21与GSDMD在体内外均直接相互作用。TRIM21通过PRY-SPRY结构域结合GSDMD,维持GSDMD在静息细胞中的稳定表达,并在细胞焦亡过程中诱导GSDMD-N高聚。NLRP3或NLRC4炎性小体激活后,TRIM21缺陷型细胞死亡率显著降低;同时在沙门氏菌感染情况下,TRIM21敲除的BMDM细胞也显著提高了存活率。此外,TRIM21敲除小鼠在脂多糖(LPS)诱导的败血症和葡聚糖硫酸钠(DSS)诱导的结肠炎模型中,炎症反应明显减弱,存活率显著提高。这项研究揭示了TRIM21在GSDMD介导的焦亡中发挥重要作用,为控制和治疗炎症相关疾病提供了全新作用靶标。
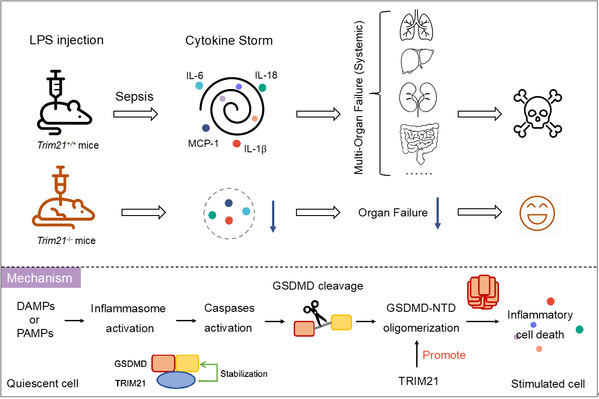
TRIM21促进GSDMD高聚,从而正向调控细胞焦亡。
高文青博士和李媛媛博士研究生为论文共同第一作者,李继喜教授和陈向军教授为论文共同通讯作者。该研究得到了国家自然科学基金委、科技部国家重点研发计划、上海市科委等项目的资助。





