真核生物有别于原核生物重要的生物特征之一,在于其大部分基因的转录本都会经历pre-mRNA选择性剪接,由此形成不同亚型的成熟mRNA,从而促进了蛋白质组的多样性产生1。心脏作为胚胎发育过程中第一个形成并发挥作用的组织器官,在其复杂的发育成熟过程中,心脏肌纤维肌节形成相关基因的pre-mRNA的选择性剪接调控起到十分重要的作用。RNA结合蛋白作为pre-mRNA选择性剪接的调控因子,其中STAR家族成员Quaking(QKI)可通过结合特定序列ACUAAC,参与调控包括肌肉祖细胞,少突胶质细胞,单核细胞,神经干细胞等很多组织细胞的选择性剪接2,但其对心脏发育成熟的作用尚未有报道。

2021年1月4日,复旦大学基础医学院孙宁课题组与美国印第安纳大学寿伟年课题组、复旦大学附属儿科医院黄国英课题组合作在Nature Communications在线发表了题为“QKI is a critical pre-mRNA alternative splicing regulator of cardiac myofibrillogenesis and contractile function”的研究论文。该研究利用CRISPR/Cas9基因编辑技术和人胚胎干细胞定向心肌细胞分化体系,结合小鼠Qki敲除模型阐明了QKI在心脏发育成熟过程中的调控作用。
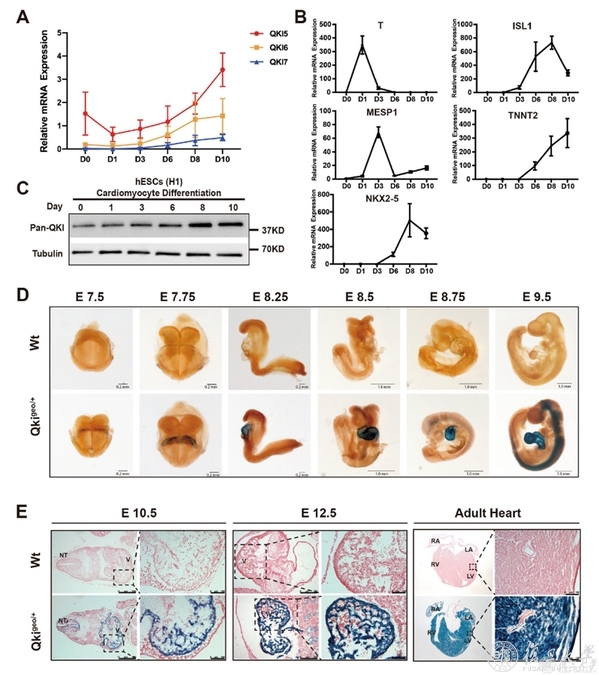
图1 Quaking在心脏发生发育过程中的表达模式
研究人员在体外胚胎干细胞心肌定向分化第6天,即心肌细胞祖细胞形成阶段发现QKI的表达开始升高,同时原位杂交技术显示在胚胎发育E7.5天qki即表达于心生区,继而在四腔室心脏的心室肌、心房肌以及成熟的心脏组织中持续表达(图1)。由于QKI敲除的胚胎干细胞系分化来的心肌细胞跳动显著减弱,研究人员通过单细胞测序和全基因组分析发现与肌节Z线相关基因的表达量及其mRNA的可变剪接均发生了改变,其中以ACTN2最为显著。ACTN2基因编码的-actinin蛋白是心肌细胞肌小节Z线结构的重要组成部分,在心肌纤维排列方面起着重要的作用,同时还协调着肌小节细胞骨架与细胞膜的相互连接3-6。研究人员接下来证实QKI可直接与ACTN2结合,介导其可变剪切的正常发生。QKI基因表达的缺失会引起ACTN2第8个外显子异常被跳跃,并使其开放阅读框发生了移码突变,提前出现了终止密码子,导致无义介导的mRNA降解。ACTN2表达异常会进一步影响心肌细胞的纤维排列,导致其缺少正常的横纹结构,收缩力减弱。
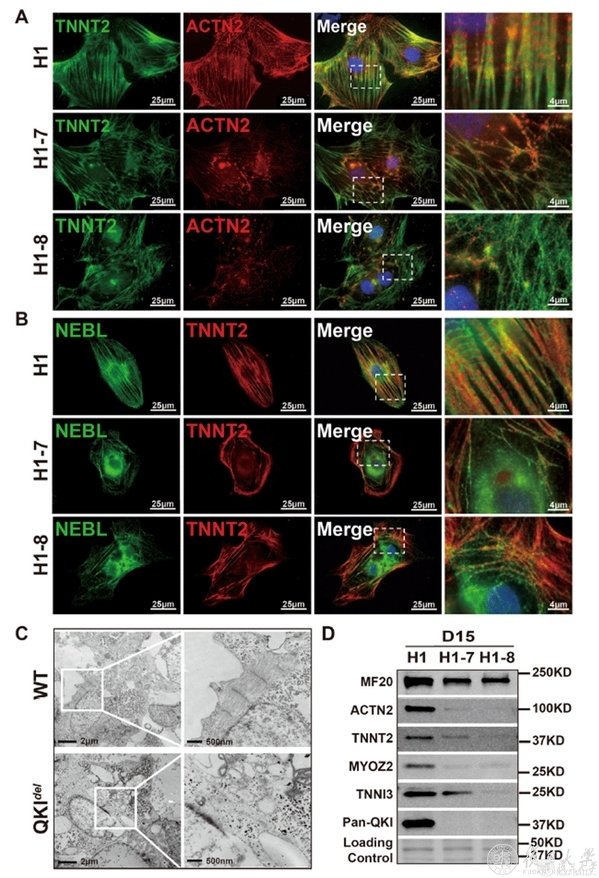
图2 QKI缺失影响心肌细胞肌丝结构的形成
综上,该研究首次阐明了QKI通过调控Z线结构基因ACTN2等的mRNA可变剪切,参与了心肌细胞肌纤维结构的形成,这为日后人类心脏疾病的研究及关联部分先天性心脏病提供了新的理论基础。
复旦大学基础医学院陈欣云博士、美国印第安纳大学刘英助理研究教授、复旦大学基础医学院徐晨讲师为论文的共同第一作者。复旦大学基础医学院孙宁研究员、美国印第安纳大学寿伟年教授、复旦大学附属儿科医院黄国英教授为论文共同通讯作者。
论文链接:https://doi.org/10.1038/s41467-020-20327-5

















