疫苗是传染性疾病预防和控制方面最有效的手段,近日,复旦大学生命科学学院和附属中山医院林金钟团队联合上海交通大学徐颖洁团队和上海蓝鹊生物医药公司(蓝鹊生物)在新冠病毒mRNA疫苗研究方面取得重要突破。2月25日,相关论文以“Towards an effective mRNA vaccine against 2019-nCoV: demonstration of virus-like particles expressed from a modified mRNA cocktail”为题在中国科学院科技论文预发布平台ChinaXiv上线。
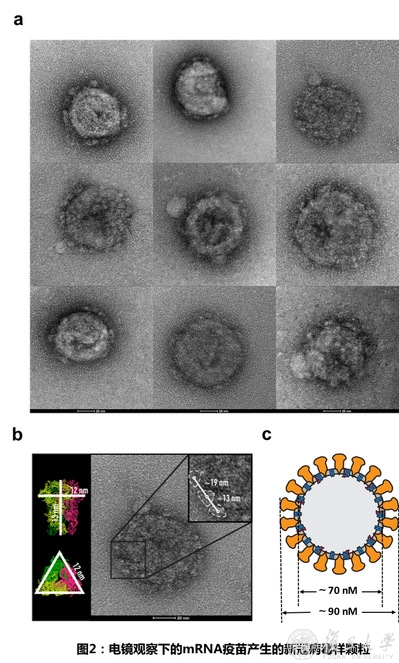
研究团队在总结非典病毒疫苗研发经验与教训的基础上,使用最新的mRNA技术,为新冠病毒疫苗研发设计了两套方案(图1)。一种是利用mRNA来表达位于新冠病毒表面的棘突蛋白以及该蛋白上识别人体细胞受体的一段区域,期望能在体内诱导产生病毒中和抗体,目前该方案进展顺利,首批疫苗小样已经用于小鼠免疫,正在等待测试效价。在另一种方案中,研究团队则尝试利用mRNA在体内表达出跟新冠病毒形状一样的空病毒,俗称病毒样颗粒。病毒样颗粒外观和真实病毒无异,但是不带有基因遗传物质,因而没有感染性,人体免疫系统却对其真假难辨,认为是真实病毒入侵,进而启动免疫产生保护性抗体,因此病毒样颗粒被认为是目前最安全有效的疫苗之一。但是使用mRNA让机体合成出病毒样粒却很有挑战,特别是结构复杂的冠状病毒,此前并无用mRNA 合成出冠状病毒样颗粒的报道。利用蓝鹊生物的mRNA药物研发平台,研发团队经过大量的序列摸索与优化,获得了能高效表达新冠病毒四个结构基因的修饰mRNA 分子,首次成功实现了SARS-CoV-2病毒样颗粒的表达。电镜照片(图2)清楚地显示了病毒外壳中由棘突蛋白(S)构成的“皇冠”,这也正是病毒进行细胞侵袭的关键部分,同时也是结合中和抗体真正有效的抗原表位。

本世纪以来已经发生了三次冠状病毒大规模感染人类事件。目前新型冠状病毒肺炎疫情防控正处于关键时期。冠状病毒的频繁现身使得其疫苗的开发迫在眉睫,具有重要的战略意义。但常规疫苗研发周期长,进展缓慢。近年来,基于体外转录的信使RNA(mRNA)疫苗正显示出巨大的潜力。mRNA疫苗的原理是,将体外制备的mRNA包裹成药物递送到体内组织被细胞内吞,外源mRNA到达细胞后被核糖体识别并根据其编码的病毒抗原信息合成相应的抗原,这些病毒抗原激活免疫系统后,产生能够阻断病毒进入细胞的中和抗体。相比传统疫苗,mRNA疫苗序列可以灵活设计,以应对不同的病原体,具有更广泛的适用性;生产周期短,生产工序更简单,成本更低,因此mRNA疫苗可以填补常规疫苗在传染性疾病爆发期的空白。但是mRNA疫苗的研发并非一蹴而就,它涉及到抗原的选择、序列的优化、修饰核苷酸的筛选、递送体系的优化、免疫效果评价、安全性测试等。一个最终有效的mRNA疫苗应该能够在低剂量下刺激机体产生足够强的免疫反应,以产生足够高的中和抗体滴度,且产生的抗体能够有效保护机体免受病毒攻击。
考虑到疫苗本身对安全性和有效性的要求极高,在最初抗原选择上的谨慎,可以很大程度降低下游实验中的试错成本。尤其是对冠状病毒,前期基于单个棘突蛋白的非典病毒疫苗由于产生了一定非中和抗体,有导致抗体依赖性感染增强的风险,因而有潜在的安全性问题。在这项研究中,研究团队发现使用mRNA疫苗表达的空病毒表面上棘突蛋白形成密致的分布,或许能够有效屏蔽非中和抗体的抗原表位,从而解决安全性的问题。同时,用mRNA合成病毒样颗粒理论上还可以同时展示来自不同冠状病毒的棘突蛋白质,那么能够同时抵抗非典病毒和新冠病毒的多效价mRNA疫苗也有可能实现。目前研究团队正在评估基于新冠病毒单个棘突蛋白和病毒样颗粒的两种mRNA疫苗的效价和安全性。





